Reglugerð um hámark dýralyfjaleifa í sláturafurðum, eggjum og mjólk. - Brottfallin
Breytingareglugerðir:
um hámark dýralyfjaleifa í sláturafurðum, eggjum og mjólk.
1. gr.
Tilgangur með reglugerð þessari er að tryggja heilbrigði neytenda með því, að ákvörðun um hámark lyfjaleifa í sláturafurðum, eggjum og mjólk sé í samræmi við almennt viðurkenndar reglur. Öryggi skal meta með hliðsjón af vísindalegu öryggismati á viðkomandi efnum, sem farið hefur fram á vegum alþjóðastofnana, einkum Codex Alimentarius eða ef þessi efni eru notuð í öðrum tilgangi, þá annarra viðurkenndra vísindanefnda.
2. gr.
Merking hugtaka í reglugerð þessari er eftirfarandi:
Leifar dýralyfja: öll lyfjafræðilega virk efni, hvort sem um er að ræða virk innihaldsefni, hjálparefni eða niðurbrotsefni og umbrotsefni þeirra, sem verða eftir í matvælum unnin úr afurðum dýra, sem hafa fengið viðkomandi lyf.
Hámark lyfjaleifa: sá hámarksstyrkur lyfjaleifa sem stafar af notkun dýralyfja (tilgreindur í mg/kg eða µg/kg miðað við þyngd ferskrar vöru) og viðurkenndur er í eða á matvælum.
3. gr.
Hámark lyfjaleifa er miðað við þá tegund og það magn lyfjaleifa sem talið er skaðlaust heilsu manna að því er eituráhrif varðar og er greint í viðteknum dagsskammti (ADI) eða á grundvelli dagsskammts, sem ákveðinn er til bráðabirgða og þar sem miðað er við einn öryggisþátt til viðbótar. Það miðast einnig við aðrar áhættur sem varða heilbrigði neytenda og tækni sem beitt er í matvælaframleiðslu.
Þegar hámark lyfjaleifa (MRL) er ákveðið er einnig tekið tillit til lyfjaleifa í fæðu úr jurtaríkinu og/eða umhverfinu. Þá er heimilt að lækka hámarksmagn lyfjaleifa til að það samrýmist góðum starfsháttum við notkun dýralyfja og að því marki sem hentugar aðferðir eru fyrir hendi til að greina lyfjaleifarnar.
4. gr.
Lyfjafræðilega virk efni, sem notuð eru í dýralyf, og búið er að ákveða hámark leifa fyrir, skulu skráð í viðauka I með reglugerð þessari. Komi í ljós við mat á lyfjafræðilegu virku efni í dýralyfi, að ekki sé nauðsynlegt að ákveða hámark leifa til að tryggja heilbrigði neytenda, skal skrá efnið í viðauka II.
5. gr.
Heimilt er að ákveða tímabundið hámark leifa lyfjafræðilega virkra efna, sem notuð eru í dýralyf við gildistöku reglugerðar þessarar, að því tilskildu að engin ástæða sé til að ætla að heilsu neytenda stafi hætta af leifum viðkomandi efnis, ef þær eru innan ákveðinna marka. Slíkt tímabundið hámark lyfjaleifa skal gilda lengst í fimm ár. Aðeins er heimilt í undantekningartilvikum að framlengja þennan frest einu sinni um tvö ár hið lengsta, ef þess er talin þörf til að ljúka vísindarannsóknum, sem verið er að vinna að.
Í undantekningartilvikum er einnig heimilt að ákveða tímabundið hámark leifa lyfjafræðilega virkra efna, sem hafa ekki verið notuð áður í dýralyf við gildistöku reglugerðar þessarar, að því tilskildu að engin ástæða sé til að ætla að heilsu neytenda stafi hætta af leifum viðkomandi efnis, ef þær eru innan ákveðinna marka.
Lyfjafræðilega virk efni sem notuð eru í dýralyf og lokið er að ákveða tímabundið hámark fyrir, skulu skráð í viðauka III.
6. gr.
Ef leifar lyfjafræðilega virkra efna, sem notuð eru í dýralyf eru hættulegar heilsu neytenda, sama í hvaða magni þær eru í afurðunum, skal efnið skráð í viðauka IV. Efni sem eru á skrá í viðauka IV er óheimilt að gefa dýrum sem gefa af sér afurðir og ætlaðar til manneldis.
7. gr.
Til að skrá í viðauka I, II eða III ný lyfjafræðilega virk efni sem ætluð eru í lyf handa dýrum, sem gefa af sér afurðir til manneldis og ætluð eru til dreifingar hér á landi, skal sá sem markaðssetur efnið sækja um leyfi til þess til heilbrigðis- og tryggingamálaráðuneytisins. Umsókninni skulu fylgja þær upplýsingar og gögn sem um getur í viðauka V.
Breytingar á viðaukum I, II, III og IV skal birta eins fljótt og auðið er.
8. gr.
Óheimilt er að takmarka dreifingu hér á landi á matvælum úr dýraríkinu á þeim grundvelli að matvælin innihaldi leifar dýralyfja ef magn leifa fer ekki yfir það hámark lyfjaleifa sem kveðið er á um í viðaukum I eða III eða ef viðkomandi efni er á skrá í viðauka II.
9. gr.
Frá 1. janúar 1997 er bannað að gefa dýrum, sem gefa af sér afurðir til manneldis, dýralyf sem innihalda lyfjafræðilega virk efni og ekki eru talin upp í viðaukum I, II eða III, nema um sé að ræða klíniskar rannsóknir sem samþykktar hafa verið og leiða ekki til að afurðir þess búfjár sem notað er við rannsóknirnar innihaldi lyfjaleifar sem geta stofnað heilsu manna í hættu.
10. gr.
Reglugerð þessi hefur á engan hátt áhrif á ákvæði sem leggja bann við notkun efna, sem notuð eru í búfjárrækt og hafa áhrif á hormónastarfsemi dýra. Þá hefur reglugerð þessi ekki áhrif á ráðstafanir sem gerðar eru til að koma í veg fyrir óleyfilega notkun dýralyfja.
Reglugerð þessi er sett með hliðsjón af tilskipun EEC nr. 2377/90, með síðari breytingum og samkvæmt heimild í lögum nr. 77/1981 um dýralækna og lögum nr. 30/1966 um meðferð, skoðun og mat á sláturafurðum og öðlast þegar gildi.
Landbúnaðarráðuneytið, 18. apríl 1995.
Halldór Blöndal.
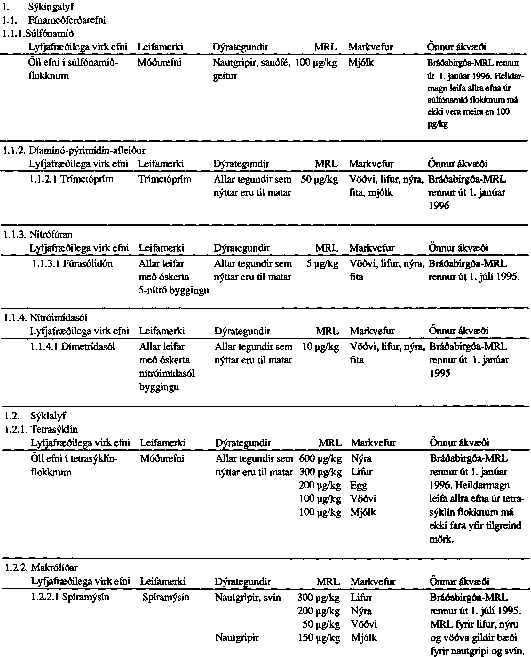
VIÐAUKI I
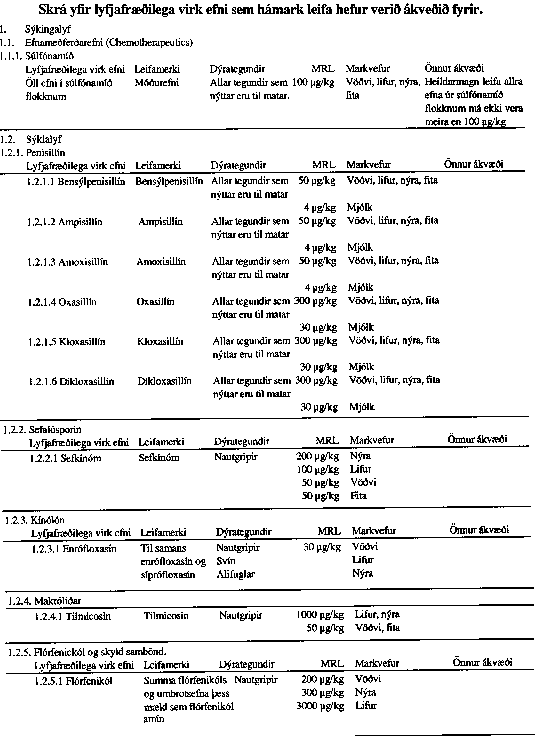
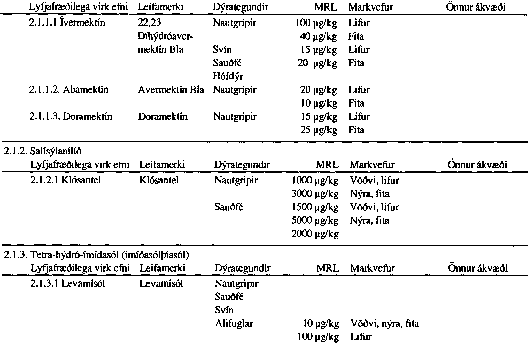
VIÐAUKI II
Skrá yfir efni sem falla ekki undir takmörkun á hámarki leifa.
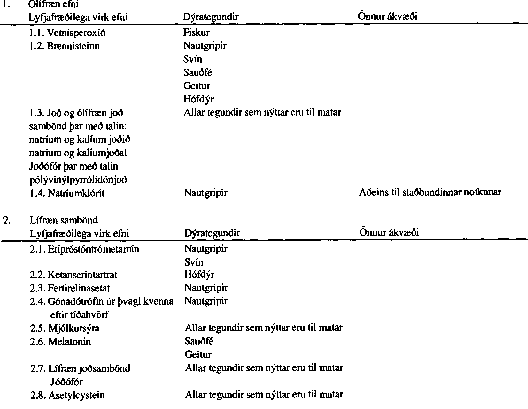
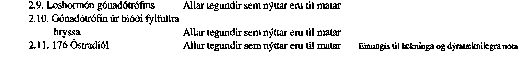
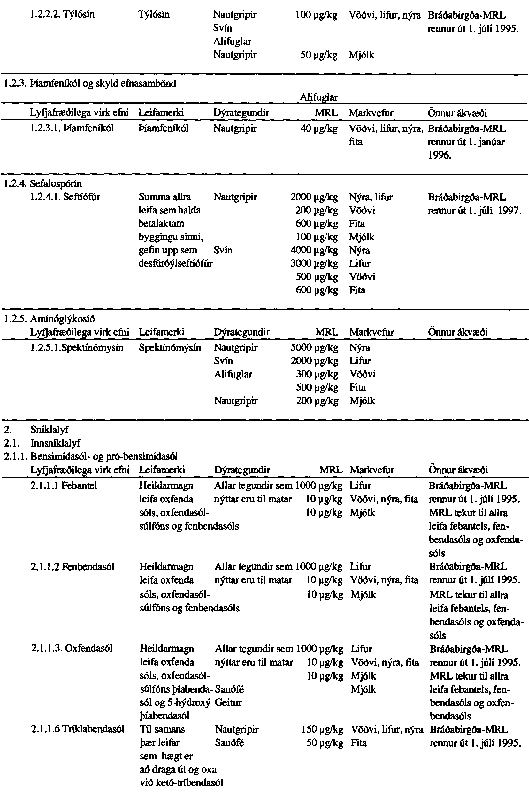
VIÐAUKI III
Skrá yfir lyfjafræðilega virk efni sem notuð eru í dýralyf og hámark leifa hefur verið ákveðið fyrir til bráðabirgða.
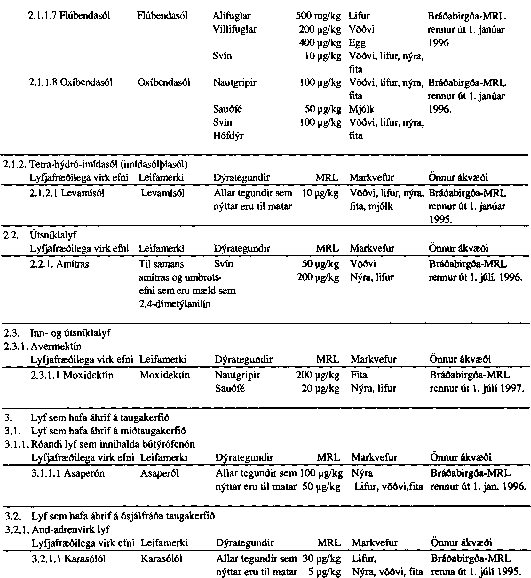
VIÐAUKI IV
Skrá yfir lyfjafræðilega virk efni sem ekki er hægt að ákvarða hámark leifa fyrir
1. Níuófiíran, nema fúrasólídbn (sjá III. viðauka)
2. Rónidasól
3. Dapsón
4. Klóramfenikól
Upplýsingar og gögn er fylgja skulu beiðni um ákvörðun á hámarki leifa lyfjafræðilega virks efnis sem notað er í dýralyf
Yfirlitsgögn:
1. Nafn umsækjanda eða firmaheiti og lögheimili.
2. Heiti dýralyfsins.
3. Heiti og magn virkra efna í lyfinu ásamt alþjóðlegu samheiti sem Alþjóðaheilbrigðismálastofnunin hefur samþykkt, sé það til.
4. Framleiðsluleyfi, ef það hefur verið veitt.
5. Markaösleyfi, ef það hefur verið veitt.
6. Samantekt á eiginleikum dýralyfsins (-lyfjanna), unnin í samræmi við 5. gr. a tilskipunar 81/851/EBE.
A. Upplýsingagögn um öryggi
A.0. Skýrsla sérfræðings
A.1. Nákvæm sannkenni efnisins sem umsbknin varóar
1.1. Alþjóðlegt samheiti (INN).
1.2. Heiti samkvæmt International Union of Pure and Applied Chemistry (IUPAC).
1.3. Heiti samkvæmt Chemical Abstract Service (CAS).
1.4. Flokkun:
--- lyfjafræðileg.
1.5. Samheiti og skammstafanir.
1.6. Byggingarformúla.
1.7. Sameindaformúla.
1.8. Mólmassi.
1.9. Hreinleikastig.
1.10. Tegund og magn óhreininda.
1.11. Lýsing á eðlisfræðilegum eiginleikum:
--- suðumark,
--- gufuþrýstingur,
--- brotstuðull, snúningur o.s.frv.
A.2. Viðeigandi lyfjafræðilegar rannsóknir
2.2 Lyfhrifafræði.
A.3. Eiturefnafræðilegar rannsóknir
3.2 Eiturhrif eftir endurtekna skammta.
3.3 Þol hjá dýrategund sem lyfið er ætlað.
3.4 Áhrif eitrunar á æxlun, þar með talinn vansköpun fósturs:
3.4.1 Rannsókn áhrifa á æxlun.
3.4.2 Eituráhrif á fósturvísi/fóstur, þar með talinn vanskapnaður.
3.5 Stökkbreytivaldar.
3.6 Krabbameinsvaldar.
A.4. Rannsóknir á öðrum verkunum
4.2 Örverufræðileg áhrif lyfjaleifa:
4.2.1 á þarmaflóru manna;
4.2.2 á lífverur og örverur sem notaðar eru í matvælaframleiðslu.
4.3 Áhrif á menn.
B. Upplýsingagögn um lyfjaleifar
B.0 Skýrsla sérfræðings
B.1. Nákvæm sannkenni efnisins sem umsóknin varðar
--- Heiti efna og magn þetta;
--- hreinleiki;
--- auðkenni framleiðslulotunnar sem notuð er við rannsóknirnar;
tengsl hennar við fullunnið lyfið;
--- eðlisvirkni og hreinleiki geislamerktra efna;
--- staðsetning merktra frumeinda í sameindinni.
B.2. Rannsóknir á lyfjaleifum
2.1 Lyfjahvarfafræði (frásog, dreifing, umbrot, útskilnaður).
2.2 Brotthvarf lyfjaleifa.
2.3 Útreikningar og skýringar á hámarksmagni leifa (MRL).
B.3. Venjubundin greiningaraðferð við athugun á lyfjaleifum
3.1 Lýsing á aðferðinni.
3.2 Gilding aðferðarinnar.
3.2.1 sérhæfni;
3.2.2 nákvæmni, þar með talið næmi;
3.2.3 samkvæmni;
3.2.4 greiningarmörk;
3.2.5 magngreiningarmörk;
3.2.7 næmi fyrir truflunum.